La parasitosis o enfermedad parasitaria sucede cuando los parásitos encuentran en el huésped las condiciones favorables para su anidamiento,
desarrollo, multiplicación y virulencia, de modo que pueda ocasionar una enfermedad.
Debido a que los parásitos están bien adaptados a sus modos de vida, son difíciles de destruir, desarrollan
estrategias para evitar los mecanismos de defensa de sus huéspedes y muchos han conseguido ser resistentes a los medicamentos e insecticidas que se aplican para su
control.
Teniasis, se llama así a la parasitosis producida por la taenia solium conocida como la "solitaria" que infesta al
hombre y se aloja en el intestino de las personas, donde crece y llega a la etapa adulta, y cuando esta en la etapa larvaria o huevo llamado cisticerco puede alojarse y enfermar al
cerebro, músculo, ojos, pulmones y
corazón, provocando la enfermedad llamada cisticercosis.
Otro tipo de parasito que afecta el organismo humano es la Giardiasis
La Giardiasis es un parásito protozoario flagelado residente del tubo intestinal humano y de muchas clases de
animales.
Tiene dos formas: trofozoíto y quiste.
El trofozoíto es la forma mótil, activa, residente intestinal, con un largo de 15 µm, ancho de 8 µm y aspecto dacrioide.
Existe otro tipo de parasito intestinal llamado Tricuriasis. Es una infección muy común al intestino grueso, que es producida en los
niños cuando comen
tierra contaminada con huevos de algún tipo de gusano.
En cuanto a la Pediculosis podemos decir que es la infección por piojos hematófagos; es decir, que se alimentan se
sangre.
Existen tres tipos de piojos que afectan a los seres humanos:
El piojo de la cabeza (Pediculus humanus capitis)
El piojo del cuerpo (Pediculus humanus corporis)
El piojo púbico o ladilla (Pediculus pubis)
Los vulgarmente llamados "piojos de la cabeza" (pediculus humanus capitis) son insectos que viven sobre el
cuero cabelludo y cabellos del ser humano. Son ectoparásitos. Estos parásitos pasan del
estado de ninfa o larva a piojo adulto en tres semanas. Su promedio de sobrevida es de treinta días y durante ese
tiempo cada hembra es capaz de poner alrededor de 200 huevos o liendres.
Parasitismo
Se llama parasitismo a la relación que se establece entre dos especies, ya sean vegetales o animales. En esta relación, se distinguen dos factores biológicos: el parásito y el huésped. El parásito vive a expensas de la otra especie, a la que se le denomina huésped.
El parasitismo intestinal se presenta cuando una especie vive dentro del huésped, en el tracto intestinal.
El parásito compite por el
consumo de las sustancias alimentarias que ingiere el huésped, o como el caso del anquilostoma, éste se nutre de la sangre del huésped, adhiriéndose a las paredes del intestino.
Tipos de parásitos.
Existen dos tipos de parásitos. Para cada
grupo se entrega la clasificación y nombres de algunos especimenes a modo de ejemplo:
Parásitos internos
Redondos: Ascaris, Ancylostomas y Trichuris
Planos: Tenias ("lombriz solitaria"), Equinococcus Granulosus y Dipylidium Caninum.

Dipylidium Caninum
Parásitos externos:
Garrapatas: es un parásito chupador de sangre dañando al huésped, actúa como vector de múltiples organismos y provoca una lesión en el sitio de fijación.Su período más activo, en nuestro país, empieza con la primavera finalizando una vez avanzado el otoño; por cuanto factores ambientales como:
temperatura, humedad constituyen limitantes para una actividad anual continuada, como ocurre en otras latitudes.Puede transmitir ciertas
enfermedades protozoarias, virales y rickettsiales del ganado doméstico y del hombre.Pulgas: es un parásito comprimido en sentido lateral, succiona sangre.La adulta se alimenta sólo con sangre de sus huéspedes causando intenso prurito e irritación por su mordedura que es constante y la secreción salivar de
productos tóxicos y alergénicos.La infección secundaria es una complicación frecuente, junto con los traumas autoinflingidos.
Pulga común
Piojos: Los vulgarmente llamados "piojos de la cabeza" (pediculus humanus capitis) son insectos que viven sobre el cuero cabelludo y cabellos del ser humano. Son ectoparásitos. Estos insectos miden en su adultez de 1 a 2 mm. Tienen seis patas que terminan en pequeñas garras (las utilizan para prenderse firmemente al pelo), tórax, abdomen y poseen una cabeza pequeña con un aparato bucal preparado para la punción (picadura) y succión ulterior de sangre.
La Giardia es un parásito protozoario flagelado residente del tubo intestinal humano y de muchas clases de animales. Las
encuestas de prevalencia en poblaciones caninas son: 10% en
perros bien
tratados, 36 a 50% en cachorros y hasta el 100% en criaderos. El hecho de que la prevalencia en gatos sea mucho menor (1,4-11%) puede reflejar la dificultad para identificar el organismo en las heces. Si bien la prevalencia de infección es elevada en perros y gatos, la enfermedad clínica es rara. La importancia de la afección reside en su prevalencia, seriedad cuando emerge, potencial zoonótico y dificultades en el
diagnóstico además de algunos inconvenientes en la farmacoterapia.
ETIOLOGIA Y CICLO BIOLOGICO
El parásito tiene dos formas: trofozoíto y quiste. El trofozoíto es la forma mótil, activa, residente intestinal, con un largo de 15 µm, ancho de 8 µm y aspecto dacrioide. A la microscopia
óptica se lo reconoce como una "cara sonriente" formada por los dos núcleos en el tercio anterior ("ojos"), los axonemas que pasan longitudinalmente entre los núcleos ("nariz") y cuerpos medianos de ubicación transversa en el tercio posterior ("boca"). Cuatro pares de flagelos completan la expresión cómica de esta forma. El quiste es el estadio inactivo, resistente, responsable de la transmisión, con un largo de 12 µm y ancho de 7 µm. Contiene dos trofozoítos formados, pero no del todo separados, y pueden verse los axonemas, fragmentos de los discos ventrales y hasta 4 núcleos. El quiste es susceptible a la desecación en condiciones cálidas y secas, pero no sobrevive varios meses fuera del huésped en ambientes fríos y húmedos.

El ciclo biológico es directo.
El huésped se infecta con la ingestión de los quistes, los cuales se exquistan en el duodeno luego de la
exposición al ácido gástrico y
enzimas pancreáticas. Entonces se separan los dos trofozoítos, maduran con rapidez y se fijan al ribete en cepillo del epitelio velloso (en el área glandular intestinal). En los perros, el organismo fue aislado desde el duodeno hasta el íleon; el duodeno y yeyuno son residencias óptimas. Los trofozoítos se aíslan con menor dificultad mediante la prueba de la cuerda peroral o endoscopia en perros sintomáticos que en asintomáticos.
En el gato se encuentran a lo largo de todo el canal entérico. Una dieta abundante en
carbohidratos, más que hiperproteica, favorece un
hábitat intestinal anterior. En las personas se describió la giardiasis estomacal con gastropatías concurrentes (Helicobacter pylori y adenocarcinoma). Los trofozoítos se multiplican por fisión binaria en el intestino y luego se enquistan mediante un mecanismo y localización que son desconocidos. Los quistes son expulsados con las heces 1 o 2 semanas después de la infección. Las heces felinas, en especial, pueden contener trofozoítos, pero pocas veces sobreviven mucho tiempo fuera del huésped.


Trofozoito emergiendo de un quiste
División binaria de la giardia
La mayoría de las infecciones donde se defecan los quistes son asintomáticas. La
diarrea es el signo clínico más común en los perros y gatos sin-tomáticos y puede ser aguda y de corta duración, intermitente o crónica. Las deposiciones con frecuencia son pálidas, malolientes y esteatorreicas. Los afectados pueden exhibir pérdida de peso secundaria a la diarrea, pero es inusual la inapetencia.
La mayor parte de la
información ha sido extrapolada de estudios en personas. La infección puede causar mal absorción de vitamina B12 y folato, triglicéridos, lactosa y (menos común) sucrosa. La respuesta clínica a la infección puede atribuirse a la virulencia de la cepa y/o factores del huésped (respuesta inmunológica). Para resistir la infección se requiere un
sistema inmune mediado por
células competente.
La administración de dosis inmunosupresoras de corticoides exacerba las giardiasis en perros y gerbos y aumenta el número de parásitos en ratones.
La sintomatología y los estudios de rutina no son patognomónicos de la giardiasis. El diagnóstico
seguro se basa en el descubrimiento de los quistes o trofozoítos en las heces o muestras extraídas del intestino. Si bien los quistes son excretados de manera intermitente, una técnica de concentración bien ejecutada es el
método más práctico y sensible de diagnosis. Los restantes
medios diagnósticos presentan inconvenientes de practicidad y sensibilidad.
Frotis fecales. Ante la sospecha de una giardiasis lo primero es realizar un frotis directo de las heces por los trofozoítos. Los trofozoítos son más comunes en las heces blandas y los quistes en las deposiciones formadas o semiformadas. Una gota de
materia fecal se mezcla con otra de solución salina normal sobre un portaobjetos,se coloca un cubreobjetos y se examina sin pérdida de tiempo a 40 X. Los trofozoítos se reconocen por su rápido
movimiento anterógrado y disco ventral cóncavo. Los tricomonales se distinguen por su movimiento más giratorio, ausencia de disco cóncavo, núcleo solitario y presencia de una membrana ondulante. La
morfología es acrecentada con el agregado de una gota de yodo de Lugol (que mata e inmoviliza al parásito tiñendo las diferentes
estructuras internas) a otra de heces. Recuérdese que un resultado negativo no descarta la infección.
La mayoría de
las drogas utilizadas tienen baja
eficacia o efectos colaterales serios. En época reciente, algunos derivados benzimidazólicos (en especial albendazol) demostraron elevada eficacia contra la Giardia in vitro y en personas. El albendazol (25 mg/kg/12 horas, bucal, durante 2 días) eliminó los quistes fecales en 18 de 20 perros tratados (90% de eficacia). La excreción de los quistes desapareció en 5 gatos tratados con este régimen durante 5 días. No se comprobaron efectos colaterales en estas dosis ni en Beagles tratados a razón de 30 mg/kg/día durante 13 semanas. Como se lo sospecha teratogénico, se contraindica en animales gestantes. El fenbendazol (50 mg/kg/día 3 días consecutivos, bucal) eliminó los quistes fecales en el 100% de los perros (total 6) de
un ensayo controlado. No hubo efectos colaterales y la
droga no es teratogénica. Con estas dosis pueden tratarse cachorros de 6 semanas de vida. Los resultados su-gieren que el fenbendazol solo puede emplearse para tratar giardiasis o descartar una infección ocul-ta (además de trichuriasis) como causa de diarrea crónica en perros. No se lo evaluó en felinos.
El metronidazol bucal (un nitroimidazol) es una droga clásica para la giardiasis canina y felina (25 mg/kg/12 horas durante 5 días para perros y 12-25 mg/kg/12 horas durante 5 días para gatos). Tiene un 67% de eficacia en perros infectados y se lo asoció con la aparición de
anorexia y vó
mito agudos con progresión a ataxia generalizada pronunciada y nistagmo posicional vertical. Los gatos suelen rechazarlo por su gusto desagradable. La quinacrina (6,6 mg/kg/12 horas durante 5 días) demostró 100% de eficacia, pero se acompaña con letargia y
fiebre hacia el fin de la terapia en cerca del 50% de los pacientes. Estos efectos desaparecen a los 2 a 3 días de finalizar la medicación. En los gatos, dosis más bajas (2,3 mg/kg/día durante 12 días) controlaron los
signos, pero sin erradicar la excreción de los quistes. Se la contraindica en preñadas.
El ipronidazol, un nitroimidazol, es un aditivo para alimento y
agua usado en el tratamiento de la cabeza negra del pavo y tricomoniasis bovina. En 2 galgos fue eficaz para tratar la giardiasis mediante
el agua de bebida (126 mg/L durante 7 días y 378 mg/L por otros 7 días). El tinidazol, otro nitroimidazol, tiene igual eficacia que el metronidazol para tratar la giardiasis. Estas
drogas no fueron testeadas en detalle.
La furazolidona es de considerable eficacia para la giardiasis felina (4 mg/kg/12 horas durante 5-10 días, bucal); los posibles efectos colaterales son la diarrea y el vómito. No fue muy evaluada en caninos. Se la presume teratogénica y por ende se contraindica en preñadas.
Con respecto a un tipo de enfermedad parasitaria ocasionada por un organismo invertebrado, conocido científicamente como Taenia solium, y comúnmente como ‘tenia’ o ‘solitaria’. Se piensa que se puede contraer la infección y la posterior enfermedad (teniasis) con sólo ingerir carne de cerdo, pero esto no es verdad. Sin embargo, otro mal (cisticercosis) que implica al mismo parásito sí es ocasionado por el consumo de la misma carne –o cualquier otra–, pero la causa se encuentra en la preparación de los
alimentos.
El adulto y el huevo de Taenia solium
El adulto de Taenia solium es un parásito estricto que vive en el intestino delgado de los seres humanos y de algunos
mamíferos más (el hámster, entre ellos, pero de forma experimental). Es un gusano plano y segmentado que en estado adulto (fig. 1) puede alcanzar hasta 7 metros de longitud. Está compuesto por una cabeza o escólex, un cuello angosto y varios cientos de proglótidos hermafroditos.
El escólex mide algo menos que una cabeza de alfiler (fig. 2). Presenta ganchos y ventosas que le sirven para fijarse a la pared intestinal de donde absorbe los nutrientes que lo alimentan.
Escólex
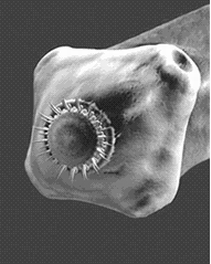
Los proglótidos constituyen la
estructura reproductiva de estos parásitos y se clasifican, de acuerdo con su desarrollo, en inmaduros, maduros y grávidos. Los primeros poseen órganos genitales poco desarrollados; los maduros presentan ovarios y
testículos desarrollados y listos para producir huevos, y los proglótidos grávidos poseen los huevos altamente infectivos (cada proglótido grávido puede contener hasta 60 000 huevos).

En el intestino del hombre puede haber uno o más individuos adheridos a la pared; éstos crecen y se reproducen asexualmente o por
fecundación entrecruzada, es decir, dos individuos localizados en el mismo intestino se encuentran y llevan a cabo contacto entre sus cavidades genitales para intercambiar células reproductivas y así
poder fecundarse uno a otro.
Una vez que se lleva a cabo la autofecundación o la fecundación entrecruzada, los huevos –
producto de la unión de las células sexuales fusionadas en la fecundación– pasan por transformaciones muy breves y después se convierten en una esfera microscópica cubierta por una capa que les confiere cierta
resistencia.
Cisticercos maduros disecados y recuperados de carne de cerdo infectada. La región clara es la pequeña larva de tenia y la región más oscura es una vesícula llena de fluido que ayuda a la larva a permanecer viva por cierto tiempo. Los cisticercos maduros pueden medir de 0.5 a 2.5 cm de diámetro

¿Cómo adquirimos teniasis?
Una vez que el cisticerco infectó a un cerdo y se alojó en su tejido muscular, su carne cruda o mal cocida es portadora del parásito. Al ser ingerida por una
persona, los cisticercos que contiene entran por la boca como alimento; posteriormente son estimulados por sustancias digestivas en el estómago y en el intestino delgado; con ello logran salir de su cápsula protectora e inician su desarrollo como adultos en el intestino del hospedero, provocan la enfermedad conocida como ‘teniasis’ y cierran así el
ciclo de vida al volver a la fase inicial .La teniasis no es mortal ni grave, pero puede tener complicaciones en ciertos casos. Un alto número de personas que la contraen ni siquiera se dan cuenta de que la tuvieron. Al cabo de algún tiempo, el gusano simplemente muere y es expulsado en la materia fecal.

El parásito adulto se desarrolla en el intestino delgado del ser humano, donde se reproduce y forma huevos (a). Los huevos están contenidos dentro de las estructuras reproductivas o proglótidos, que son expulsados en las heces (b). El huevo presente en la materia fecal puede ser ingerido por el ser humano (c1) o por el cerdo (c2). Una vez dentro del tracto digestivo se convierte en cisticerco y se puede alojar en: el cerebro, el hígado, los músculos o los ojos (entre otros
tejidos). El ciclo se cierra cuando el ser humano ingiere carne con cisticercos; en este caso los cisticercos llegan al tracto digestivo humano e inician su desarrollo como adultos.
Sin embargo, si existiera la posibilidad de alimentarnos con carne de cerdo infectado con cisticercosis (es decir con cisticercos implantados en el tejido muscular) estaríamos ingiriendo los cisticercos y no los huevos, lo que provocaría que el cisticerco se desarrollara en nuestro intestino como adulto; entonces el diagnóstico que nos haría el medico sería el de teniasis y no el de cisticercosis. La cisticercosis la provoca el huevo de Taenia solium y la teniasis el cisticerco, contrario a lo que se cree.
Podemos decir que para no contraer cisticercosis o teniasis lo mejor que podemos hacer es:
1.Comer en lugares limpios.
2.Lavarnos siempre las manos antes de comer y después de ir al baño.
3.Lavar y/o cocer muy bien frutas, verduras y carnes (sea de cerdo o no).
4.No comer ningún tipo de carne, y mucho menos la de cerdo, cruda.
5.Si vivimos en zonas rurales donde se crían cerdos, mantenerlos en perfecto estado de limpieza y evitar que se alimenten con heces humanas.
Por otro lado, si queremos evitar contraer teniasis lo único que tomaremos en cuenta es ingerir carne libre de cisticercos, lo cual se puede hacer consumiendo carne con sello de inspección sanitaria, y en el caso de cerdos criados en granjas particulares, manteniendo un alto nivel de
higiene en su crianza revisando y cociendo (pues el cisticerco muere a temperaturas mayores a 79° C) la carne antes de ingerirla, tratando de identificar algún cisticerco presente en ella.
Por último, es importante mencionar que en caso de haber adquirido cisticercosis humana debido a la ingestión de huevos de solitaria, tenemos que considerar que hasta ahora no se conoce una forma para saber si el cisticerco se ha desarrollado en nuestro organismo. Por lo tanto, en la mayoría de los casos, las personas que en algún momento de su vida contrajeron este mal, pueden pasar años con el o los cisticercos en su cerebro, su hígado o sus músculos hasta que el parásito ocasiona daños severos a la parte del cuerpo donde se encuentra; lo cual, dependiendo de la zona, puede variar entre algunos meses y hasta 8 o 9 años.
Lo anterior nos dice que la cisticercosis y la teniasis humana y porcina son, más que
problemas alimentarios, problemas de higiene y
educación sanitaria, problemas que se pueden solucionar transmitiendo desde el aula las medidas sanitarias más comunes y los hábitos de limpieza básicos para ingerir y preparar alimentos.

Ciclo biológico de las especies del
género Taenia.
Huevo del género Taenia.

TRICURIASISTrichuris Trichura
Es el parásito conocido como tricocéfalos, que produce la enfermedad conocida tricuriasis.
Es la infección parasitaria del intestino grueso causada por trichuris trichura

Causas, incidencia y factores de riesgo
La infección es común en todo el mundo y afecta principalmente a los niños, quienes la pueden desarrollar a partir de la ingestión de tierra contaminada con huevos de este gusano, los cuales se incuban incrustándose en la pared del intestino grueso (ciego, colon o recto).
El principal factor de
riesgo de infección comprende la ingestión de huevos en tierra contaminada con heces. Algunos brotes se han rastreado hasta vegetales contaminados, debido a posible
contaminación con
la tierra.
El desarrollo de los síntomas depende de la cantidad de gusanos o huevos. Las infestaciones leves pueden ocasionar pocos o ningún síntoma, mientras que las infestaciones mayores pueden provocar diarrea sanguinolenta,
anemia por deficiencia de
hierro y, en ocasiones, prolapso rectal.
Las personas infectadas que no usan la letrina sanitaria, contaminan el
suelo con materia fecal, que contiene los huevecillos del parásito.
Con el
calor, la humedad del suelo y la sombra, los huevos maduran y se convierten en embriones del parásito. Este
proceso lleva tres semanas.

"Forma de transmisión"
Las personas, principalmente los niños, pueden ingerir los embriones del parásito, por medio de las manos sucias, el polvo, el agua, los alimentos, las frutas, y los objetos contaminados.
Los embriones del tricocefalos ingeridos bajan al estomago y llegan al intestino grueso, donde se concierten en gusanos adultos.
En el intestino grueso los gusanos se pegan a las paredes, se alimentan y se multiplican, produciendo malestar estomacal intermitente, diarrea, perdida de peso y anemia.
Síntomas, Signos, exámenes
SINTOMAS
Las infestaciones leves son a menudo asint
omáticas.
Las infestaciones mayores pueden presentar diarrea sanguinolenta.
La pérdida de sangre prolongada puede conducir a anemia por deficiencia de hierro.
En casos severos entre individuos altamente infestados se presenta prolapso rectal.










 sangre entra en contacto con una superficie "extraña", es decir, diferente al
sangre entra en contacto con una superficie "extraña", es decir, diferente al 





































